Опубликовано в журнале:
Поликлиника 2/2014
Н.И. Стуклов, д.м.н., профессор кафедры госпитальной терапии РУДН, руководитель курса гематологии и клинической базы кафедры
М.Ю. Кунина, врач гематолог ООО Клиники «Будь здоров»
Е.Н. Семенова, учебный мастер кафедры госпитальной терапии РУДН Эффективность терапии железодефицитной анемии определяется не только биодоступностью железа из препарата, но также зависит от приверженности к лечению самого больного, на что существенным образом влияет переносимость препарата и стоимость лечения. Эффективность препаратов, содержащих двухвалентное железо доказана в многочисленных исследованиях (степень доказательности 1А) и не вызывает сомнения. Препараты на основе трехвалентного железа лучше переносятся, но не всегда эффективны и требуют более длительных курсов лечения. Благодаря уникальному составу (сульфат железа II + экдистерон +туркистерон), позволяет быстро восстанавливать концентрацию гемоглобина и депо железа и при этом обладает хорошей переносимостью. Более того, препарат может применяться в более низких дозах, чем глюконат железа без потери эффективности лечения. Экдистерон и Туркистерон входят в активные центры белков, обеспечивающих активный транспорт железа в кишечнике и быструю утилизацию, поступившего в кровь железа, тканями. Они входят в состав основных белков антиоксидантной защиты. Также экдистерон участвует в синтезе гемоглобина, регулирует поступление железа в митохондрии. Сравнение результатов трех мета-анализов показало, что препарат обладает лучшей переносимостью (частота побочных эффектов 10,4%), чем глюконат железа II (34,1% и 20,4%; р<0,005) и сравнимой переносимостью по отношению к препаратам трехвалентного железа (полимальтозный комплекс гидроксида железа III (14,9%; 0,1<р<0,25), протеин сукцинилат железа III (9,4%; 0,75<р<0,9)). Более того, при приеме препарата в 19 раз реже возникают запоры, чем при приеме в комбинации сукцината железа II и в 10 раз реже, чем при приеме полимальтозного комплекса гидроксида железа III, что очень важно для беременных женщин, часто страдающих запорами, особенно в III триместре беременности. При этом Тотема относится к средней ценовой категории, что делает его оптимальным для терапии большого количества пациентов.
Введение
Актуальность проблемы ранней диагностики и адекватного лечения железодефицитной анемии (ЖДА) у любого человека и тем более у беременной женщины переоценить невозможно. Биологическая роль железа велика: оно участвует в окислительновосстановительных процессах, росте и старении тканей, механизмах иммунитета, кроветворении, снабжении органов и тканей кислородом, функционировании множества ферментов. Дефицит железа и, тем более, манифестная его стадия – ЖДА является причиной снижения работоспособности и повышения эмоциональной лабильности, раздражительности у взрослых, увеличения частоты острых респираторных заболеваний, вызывает задержку роста и развития детей [1]. ЖДА у беременных может приводить к повышению частоты гестозов, преждевременных родов, пиелонефрита, плацентарной недостаточности, отставания роста и развития, внутриутробной гибели плода; инфекционным осложнениям, повышенной кровопотери в родах и послеродовый период, слабости родовой деятельности [1]. Недостаточное депонирование железа в антенатальном периоде является одной из причин развития железодефицитных состояний у грудных детей, что в дальнейшем приводит к снижению у этих детей интеллектуального развития, работоспособности и нарушениям поведения [1]. Важнейшими задачами научной медицины и практического здравоохранения сегодня являются ранняя диагностика, лечение и профилактика ЖДА особенно у женщин репродуктивного возраста и беременных с целью получения здорового поколения в будущем.
В современной медицине большое внимание уделяется личности самого больного, его платежеспособности и дисциплинированности, а также его пониманию роли и влияния болезни на жизненное функционирование и качество жизни. Зачастую неустойчивый эффект от проводимого лечения складывается из боязни принимать какие-либо препараты во время беременности, плохой переносимости назначенного препарата или нехватки денег на лечение. Также возможно из-за несерьезного отношения пациента к своему здоровью, непонимания последствий железодефицита, как для себя, так и для здоровья новорожденного. Поэтому важно не только информировать пациента о последствиях железодефицитного состояния, но и подобрать оптимальный для каждого конкретного больного препарат, а для этого необходимо понимать от чего зависит эффективность и переносимость препаратов железа, и сколько будет стоить выбранное лечение.
Все пероральные препараты железа (ПЖ) принципиально можно разделить на препараты двухвалентного и трехвалентного железа, так как именно это в первую очередь определяет их биодоступность и соответственно скорость восстановления гемоглобина, эритроцитарных индексов и депо железа, а также переносимость терапии (Рис. 1). Соли двухвалентного железа показывают лишь незначительные различия между собой по эффективности всасывания железа. Соли трехвалентного железа всасываются хуже (уровень доказательности 1А) [4] , Это связано с различиями в механизме всасывания. Доказано биодоступность двухвалентных солей железа в несколько раз выше, чем трехвалентных [4, 5, 6], так как они свободно диффундируют через каналы ДМТ1-белков и ферропортин. Поэтому препараты содержащие в составе двухвалентное железо, оказывают быстрый эффект и нормализуют уровень гемоглобина в среднем через 2 недели – 2 месяца, а нормализация депо железа происходит уже через 3–4 месяца от начала лечения, в зависимости от тяжести анемии и дозировки препарата. Всасывание железа из препаратов трехвалентного железа более медленное, так как необходим активный (энергозависимый) транспорт с участием феррооксидаз. Поэтому препараты, содержащие железо в трехвалентном состоянии требуют более длительного применения, а в случае дефицита меди в организме, будут неэффективны вовсе [2]. Нормализация гемоглобина при лечении препаратами трехвалентного железа наступит только спустя 2–4 месяца, а нормализация показателей депо железа через 5–7 месяКлассификация препаратов железа зависит от используемой дозировки. Чем выше доза.
Степень доступности железа отражается и на частоте побочных эффектов. Уменьшить побочные действия пероральных таблетированных ПЖ на желудочно-кишечный тракт можно, принимая железо с едой, но за счет уменьшения всасывания, или можно использовать формы с замедленным высвобождением [5], так же с потерей эффективности, так как часть препарата будет высвобождаться в нижних отделах кишечника, где железо практически не всасывается. Несмотря на рекомендации ВОЗ по применению для лечения ЖДА препаратов двухвалентного железа, как более эффективных, препараты с низкой биодоступностью на основе трехвалентного железа, активно применяются благодаря их лучшей переносимости [8, 9]. Однако это не всегда оправдано, поскольку есть данные о неэффективности применения полимальтозного комплекса гидроксида железа III (ПКГЖ), даже при длительном лечении (от 4 до14 месяцев), у значительного количества пациентов (75 (31%) из 241) [10]. Последующий перевод этих пациентов на препараты двухвалентного железа приводил к быстрой нормализации гемоглобина [10, 11].
Частота нежелательных явлений зависит не только от степени абсорбции, но и от характеристик самой соли. Так органические соли (глюконат, фумарат) обладают хучшей переносимостью, чем неорганические (сульфат) [2, 3, 13]. Форма выпуска солевых препаратов тоже играет важную роль в переносимости (Таблица 1). таблетированные формы имеют лучшую всасываемость (до 40%), при этом, создаются меньшие локальные концентрации железа [3]. Для препаратов гидроксида железа в комплексе с полимальтозой форма выпуска не имеет значения, так как гидроксид железа – это нерастворимое соединение (основной компонент «ржавчины»). Полимальтоза образует многоядерные комплексы с гидроксидным осадком, поддерживая размер частиц порядка 55 кДа и предотвращая дальнейшее наращивание ядер. По этой причине, препараты на основе гидроксида железа в комплексе с полимальтозой (ГПК) рекомендуется принимать с пищей, что улучшает их биодоступность до 8–10 % [5]
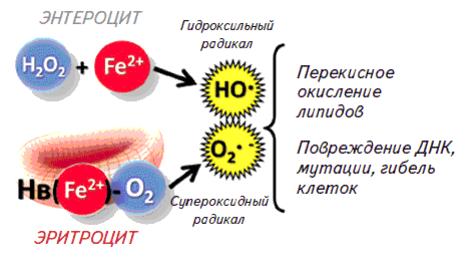
Проблемы, возникающие при лечении ЖДА препаратами, содержащими только железо
Единственным антианемическим препаратом, содержащим сразу три компонента способный не только восполнить недостающее при анемии железо, но и усилить антиоксидантную защиту. Высокий лечебный эффект препарата связан с несколькими особенностями препарата – это, улучшающая распределение препарата по слизистой кишечника, и наличие экдистерона и туркистерона, которые играют важную роль в метаболизме железа и входят в активные центры супероксиддисмутаз. Наличие экдистерона и туркистерона в препарате не только увеличивает биодоступность железа, что позволяет снизить эффективную дозу, но также нормализует усвоение железа тканями и блокирует образование свободных радикалов, как за счет быстрой элиминации 2-х валентных ионов железа с помощью церулоплазмина (медь-зависимая феррооксидаза), так и за счет активации антиоксидантной защиты.
Литература
- Коноводова Е.Н. Железодефицитные состояния: когда и кому назначать Сульфат железа+Фитоэкдистероиды // Поликлиника. 2012; 5: 1-5
- Громова О.А., Торшин И.Ю., Хаджидис А.К. Анализ молекулярных механизмов воздействия железа (II), фитоэкдистероиды в патогенезе железодефицитной анемии. // Клиническая фармакология и фармаэкономика. 2010; 1: 1-9.
- Goddard A.F., James M.W., Mclntyre A.S., Scott B.B. Guidelines for the management of iron deficiency anaemia. // British Society of Gastroenterology. 2011.
- UK guidelines on the management of iron deficiency in pregnancy British Committee for Standards in Haematology. July 2011.
- Harju E. Clinical Pharmacokinetics of Iron Preparations // Clin.Pharmacokinet. 1989; 17(2): 69-89.
- Palacios Santiago. Ferrous versus Ferric Oral Iron Formulations for the Treatment of Iron Deficiency: AClinical Overview. // The Scientific World Journal. 2012; Vol.2012, Article ID 846824
- Nielsen P., Gabbe E.E., Ficher R., Heinrich Н.С. Bioavailability of iron from oral ferric polymaltose in humans // Arzneimittel-Forschung/ Drug Research. 1994; 44(6): 743-8.
- Jorge E.Toblli, Reto Brignoli Полимальтозный комплекс гидроксида железа (III) при железодефицитной анемии. Обзор и метаанализ. // Анемия. Журнал рабочей группы по анемии. 2008; Приложение к №1: 95-104.
- Kopcke W., Sauerland M.C. Мета-анализ данных эффективности и переносимости железа протеинсукцинилата при лечении пациентов с железодефицитной анемией разной степени тяжести. // Arzneimittel- Forchung/Drug Research. 1995; 45(II), 11: 1211-6.
- GuillermoJ. Ruiz-Arguelles, Angeles Diaz-Hernandez, Carlos Manzano, GuillermoJ. Ruiz-Delgado. Ineffectiveness of oral iron hydroxide polymaltose in iron-deficiency anemia // Hematology. June 2007; 12(3): 255-256.
- Mehta BC. Iron (III) hydroxide polymaltose isineffective iv treatment of iron deficiency anemia. // Medical Image. 2001; 25: 36-7.
- Стуклов Н.И., Мета-анализ данных переносимости сульфата железа (II), фитоэкдистерона при лечении железодефицитной анемии у детей и взрослых. // Земский врач. 2012; 4(15): 11-20.
- Casparis D., Del Carlo P., Braconi F., Grossi A., Merante D., Gafforio L. Effectiveness and tolerability of oral liquid ferrous gluconate in irondeficiency anemia in pregnancy and in the immediate poste-partum period: comparison with other liquid or solid formulations containing bivalent or trivalent iron. // Minerva Ginecol. 1996; Nov, 48(11): 511-8
- Машковский М.Д. Пособие для врачей. Лекарственные Средства. // Харьков «Торсинг». 1997; Том 2: 156-161
- Владимиров Ю.А. и соавт., Свободные радикалы в живых системах. // ВИНИТИ Итоги науки и техники. Москва. 1991; Биофизика, Том 29: 1-250
- Davis C., Greger J.L., Longitudinal changes of manganese-dependant superoxide dismutase and other indexes of manganese and iron in women. // Am. J. Clin. Nutr. 1992; 55: 747-752
- Семенова Е., Кунина М., Стуклов Н., Роль фитоэкдитстерона в метаболизме железа. // Врач. 2013; №12: 47-52
22 мая 2014 г.